ICU中的血浆置换:一篇叙述性综述
6809年10月05日 阅读:124次

ICU中的血浆置换:一篇叙述性综述
河北医科大学第四医院重症医学科
宋睿翻译 朱桂军校对
摘要
在这篇叙述性综述中,我们讨论了危重患者治疗性血浆置换(TPE)的相关问题。在许多情况下,最佳适应症、设备类型、频率、持续时间、置换液类型和停止TPE的标准都不确定。TPE 是一种可能挽救生命但也是具有不良事件和并发症风险的侵入性治疗操作,需要经验丰富的团队密切监测。在ICU中,TPE的适应症可分为(1)绝对的、公认的、循证的,TPE 被认为是一线治疗,(2)相对的,TPE是公认的二线治疗(单独或联合)和 (3) 抢救治疗,其中TPE的使用具有有限的或理论证据基础。 新的适应症正在出现,加上持续存在的知识差距,因此特别是关于在危重疾病期间使用 TPE,支持建立一个专注于ICU的 TPE 登记。
介绍
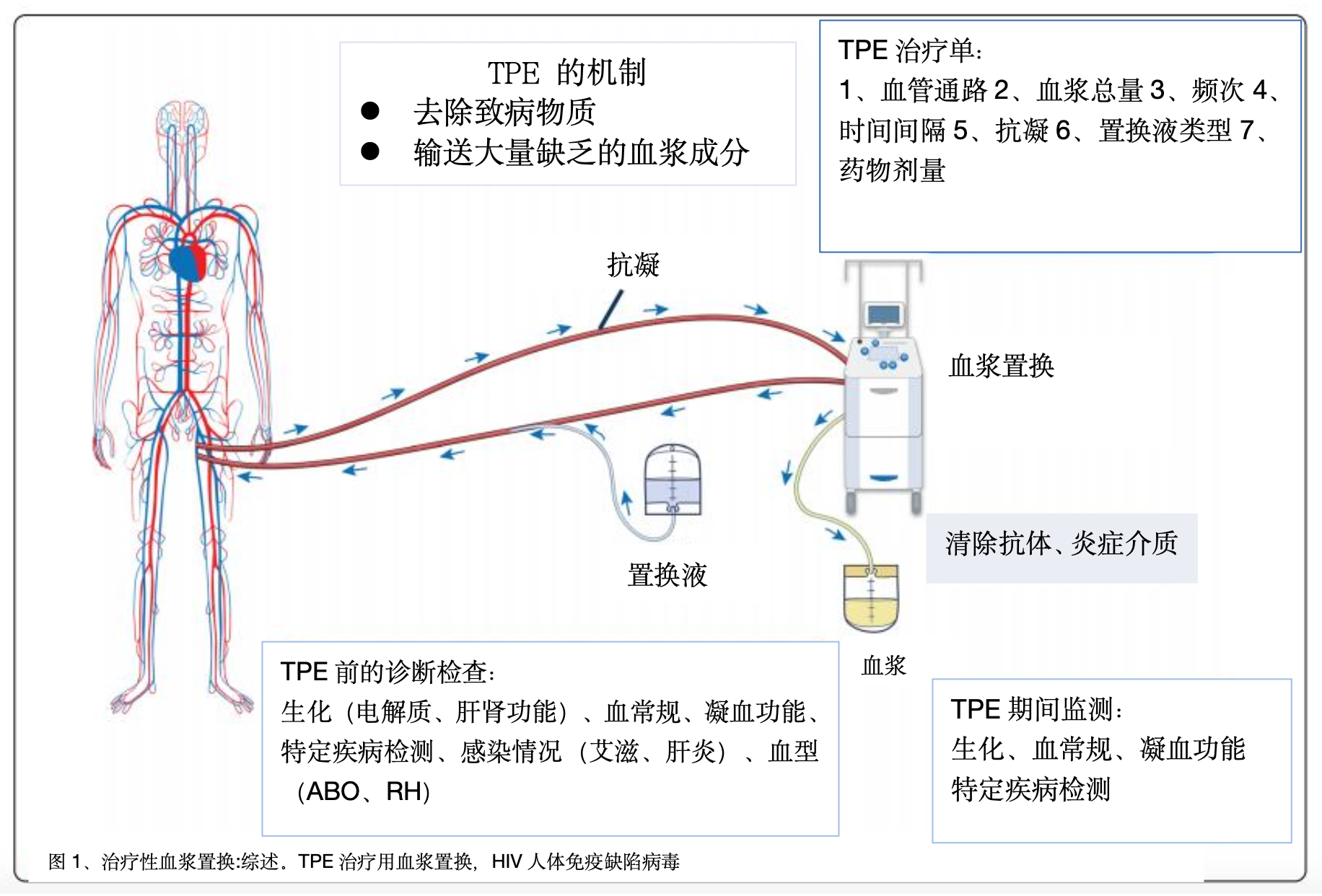
治疗性单采包括从患者血液中去除血浆(血浆置换)或血细胞(细胞单采,即红细胞、白细胞或血小板)。如果移除血浆不是为了捐献而是为了治疗,并用供体血浆、胶体、晶体或其混合物代替,则定义为治疗性血浆交换(TPE)(图1)。TPE用于去除致病物质(例如自身抗体或毒性物质)和/或施用健康供体血浆中存在的缺陷物质(例如具有凝血酶敏感蛋白1的去整合素-金属蛋白酶,ADAMTS13 ),尽管可能涉及其它潜在的免疫调节作用。随着时间的推移,TPE的适应症已经得到完善。许多需要TPE的病人都是危重病人,需要住进ICU。TPE 是一种侵入性操作,通常具有紧急指征,需要尽快执行。因此,由经验丰富的工作人员快速响应、配备特定设备、密切监控和多学科管理是必不可少的。
本文的目的是对危重患者TPE的主要适应症及其主要特点进行叙述性回顾。一个由重症监护医师、免疫学家、肾病学家、病理学家和血液学家组成的多学科小组审查并总结了关于治疗的基本原理和适应症的证据,分享他们的经验,并确定了需要ICU医师了解的相关问题,以及需要通过未来研究填补的知识空白。
危重患者紧急TPE 的指征
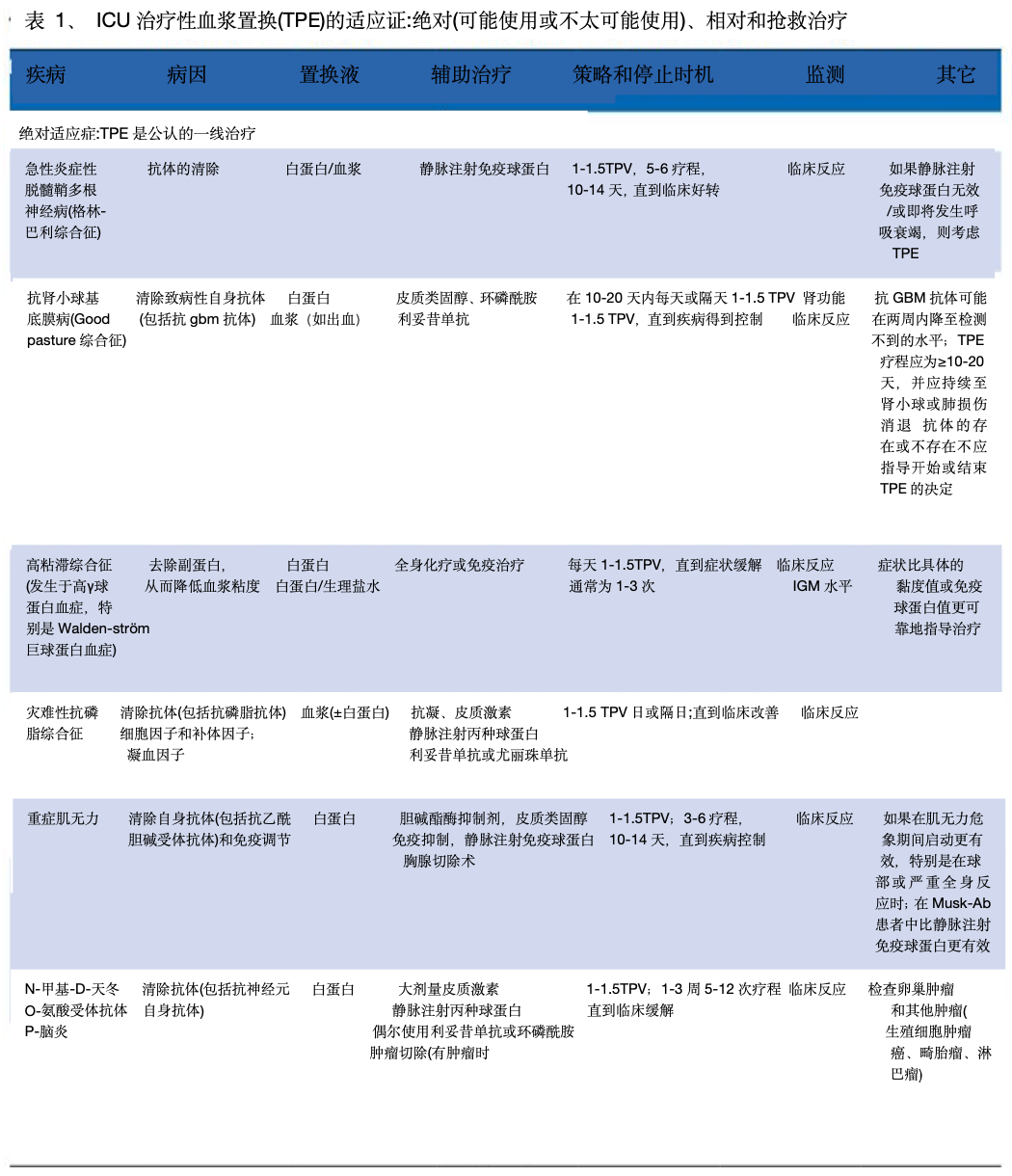
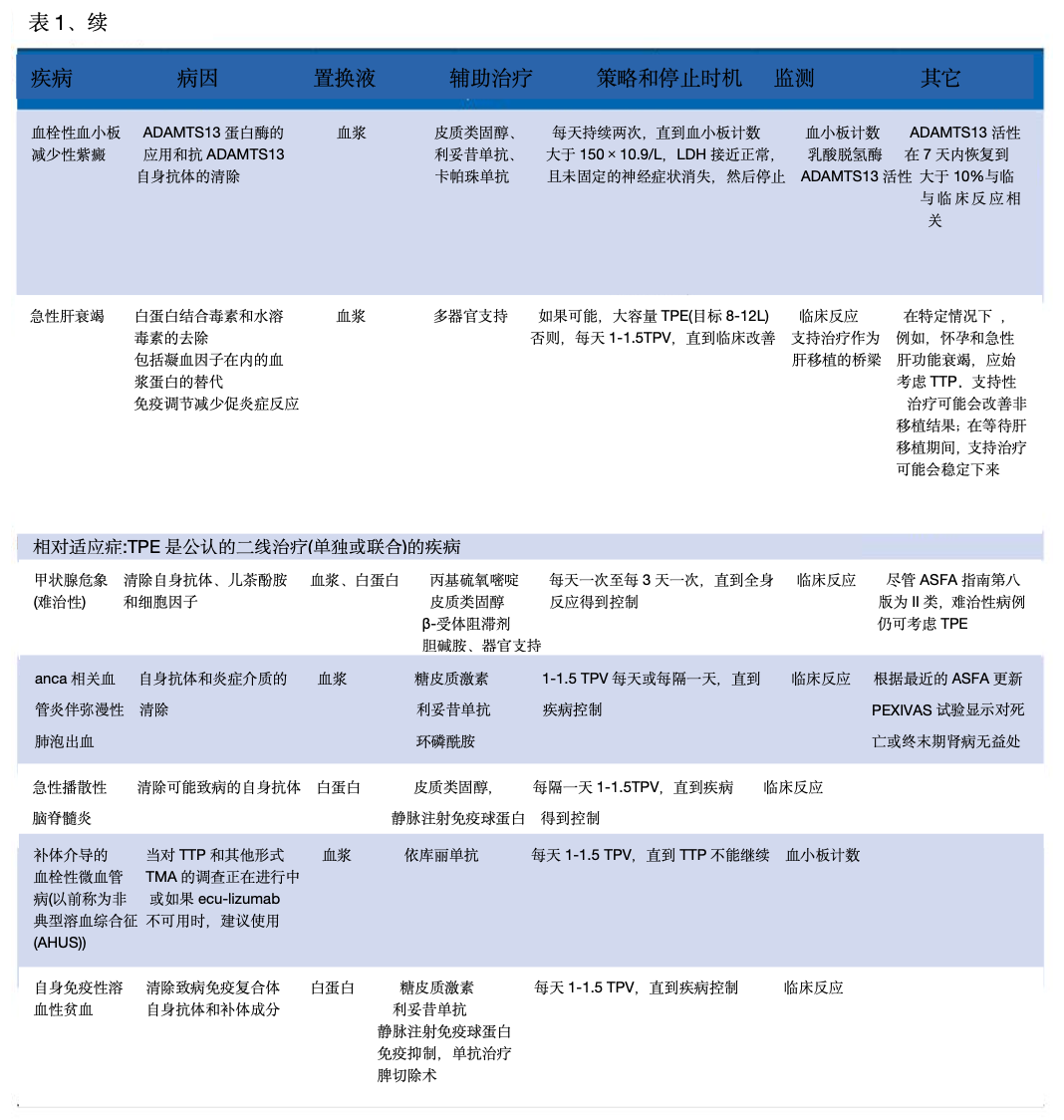
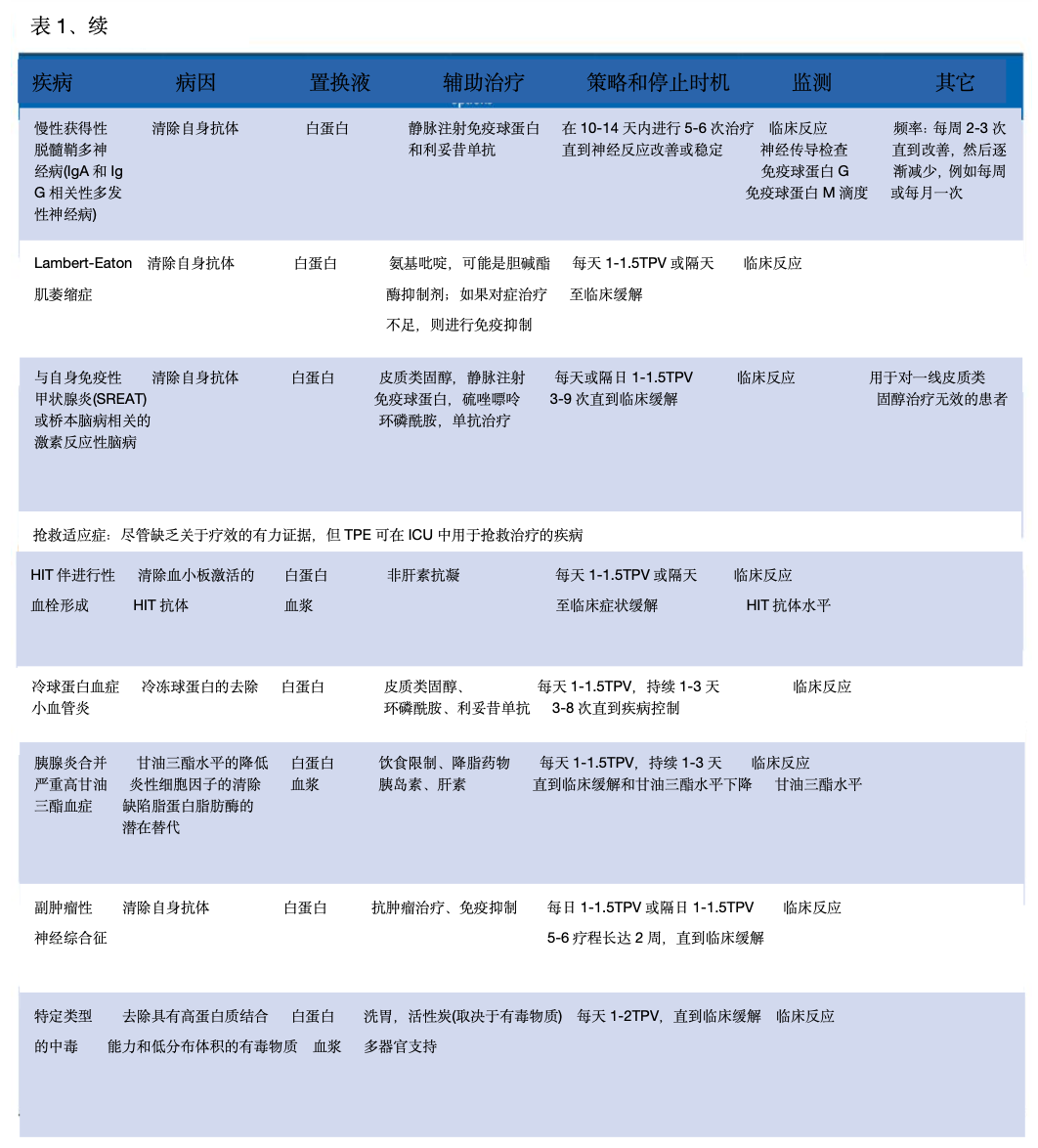
美国单采学会(ASFA) 于 2019 年更新了治疗性单采指南,日本学会于 2021 年更新了其指南。他们确定了四类使用:一线治疗(I 类)、二线治疗(II 类)、未确定作用(III 类)和无效或有害(IV 类)。在 ICU 中,TPE 的适应症可分为(1)绝对的、公认的、循证的,TPE 被认为是一线治疗,(2)相对的,TPE 是公认的二线治疗。单独治疗或与其他干预措施相结合,以及 (3)抢救治疗,其中使用 TPE 的获益证据有限,但有合理的理论依据(表1)。
TPE 的机制、动力学和目标
TPE 的机制
TPE 有两种作用机制(图 1):1、从血浆中去除致病物质(例如,重症肌无力患者的 IgG、Waldenström 巨球蛋白血症中的 IgM,或 ABO 不相容器官移植前的 IgG 和 IgM 异凝集素)。为了被 TPE 有效清除,理想情况下该物质应被识别和分析,并具有高分子量、低分布体积(主要在血浆中)、长半衰期和低周转率。值得注意的是,物质去除的程度并不一定与重症肌无力等临床症状的缓解相关。2.输送大量缺乏的血浆成分(例如血栓性血小板减少性紫癜 (TTP) 中的 ADAMTS13)。用于血浆置换的液体应该是或来源于健康的供体血浆。

动力学模型
已经建立了预测物质去除的动力学模型。在计划TPE选择的强度和频率时,必须考虑待去除物质的半衰期和分布体积。要替换的血浆量通过计算患者的总血容量和总血浆量(TPV)来确定。对于既不是快速合成也不是重新分配和限制到血管内空间的物质,第一次血浆置换将去除65%-70%的目标物质。随着更多的血浆体积的交换,由于清除的指数性质,清除的绝对量逐渐变小(图2)。第二次治疗将去除额外的 23%,第三次治疗仅去除额外的 9% 的目标物质。净减少将受到从血管外到血管内的再分配、生产率和分布容积的影响。例如,一个标准的 TPE 疗程替代 1.2 倍的 TPV 将清除 10 g 的 IgG 和 0.3 g 的 IgM,这是由于IgG存在于血管内空间,并且它能够从血管外腔重新分配,而IgM不会出现这种情况。这也取决于基线时的IgG水平(图2)。在IgG耗尽的患者中,TPE可以替代缺失的IgG。
2019年ASFA建议建议交换单独计算的TPV的1.0-1.5倍。然而,几项临床研究表明经常达不到这一目标。德国的一项研究报告仅交换估计的 TPV的 0.4-1.0 倍。在印度最近的一项研究中,TPE 期间各种适应症的总体交换量仅为 2.1 L,总体响应率为 84% 。最佳交换量未知,可能取决于疾病。小容量血浆交换将从血浆中清除较少的物质,但可能更实惠有效。例如,在孟加拉国,大多数格林-巴利综合征(GBS)患者无法负担标准的静脉免疫球蛋白治疗或标准的TPE疗程,一项针对20名成年GBS患者的小型临床研究证明了小容量血浆置换作为一种潜在的低成本替代治疗的可行性和安全性。尚未描述大剂量 TPE 的有害作用,但应记住,TPE 还去除了旨在治疗潜在疾病的药物,例如利妥昔单抗或卡帕珠单抗或抗生素或抗凝剂等基本药物。此外,如果目标是清除较大的物质,TPE 的功效将随着总交换量的增加而降低,因为清除的较大量的病理物质可能需要数小时至数天才能从血管外扩散到血管内。在这种情况下,重复 TPE 疗程可能比继续大容量 TPE 超过 1-1.5 个血浆体积更有效。了解要去除的物质的特性和动力学对于指导TPE 处方至关重要。实现最有效物质清除的最合理方法是考虑要去除的毒素的性质以及交换量、治疗频率和时间的最佳组合。
TPE的治疗目标
TPE 的治疗目标取决于疾病的病理生理学。例如,在 Waldenström 巨球蛋白血症中,目标是降低 IgM水平以降低血浆粘度并解除低灌注症状。 在 TTP 中,目标是通过去除抗 ADAMTS13 抑制抗体、清除超大血管性血友病因子多聚体和替换 ADAMTS13 酶来将血小板计数提高到 150,000/µL 以上并逆转溶血。在重症肌无力患者中,目的是通过清除乙酰胆碱受体抗体来实现快速临床稳定,特别是在肌无力危象的情况下。在GBS中,目标是提高肌肉力量,减少对机械通气的需求,加快康复。表1显示了ICU中用于监测不同TPE适应症的主要参数和停止时机(表1)。
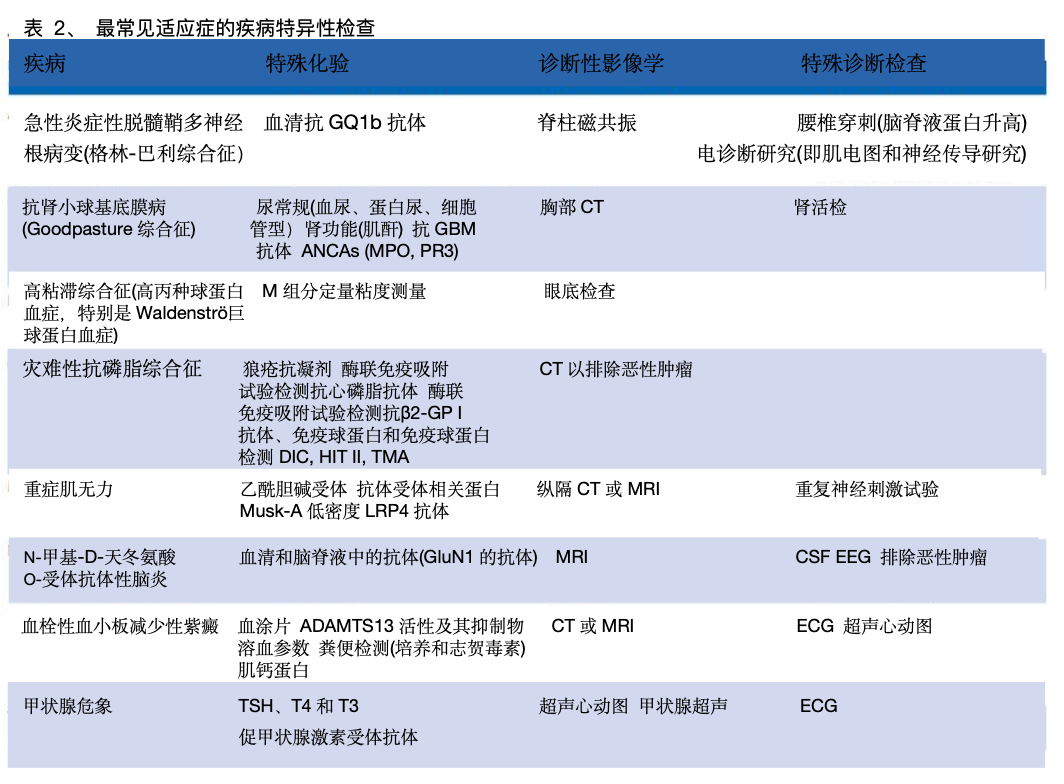
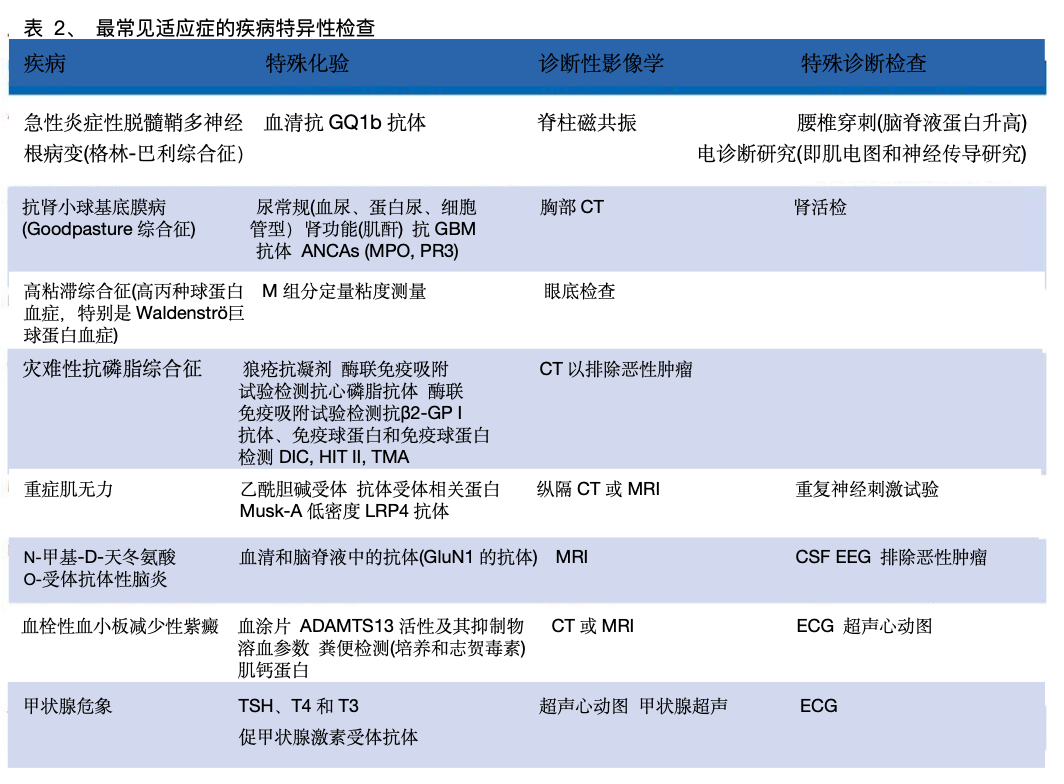
TPE适应症和监测的诊断检查
TPE用于各种医疗条件。诊断检查用于识别基础疾病并确定其特征(表2)。在TPE期间,密切监测对预防不良事件和确保疗效和安全性至关重要。中止TPE的标准应事先确定。许多常规生物标志物(如c反应蛋白(CRP)、肌酐、胆红素等)在TPE后会降低,可能会降低数小时,因此必须谨慎解释。TPE去除物质量的变化不一定代表疾病过程的改善,应寻求临床反应(如症状缓解)等额外证据(表1)。同样,TPE后CRP水平下降并不一定意味着炎症和/或感染得到控制。
技术方面
机器和设备
在TPE过程中,血浆可以通过离心法、膜过滤或两者结合的方法从血液中分离出来。离心法是根据不同血液成分的密度差异而定的。成熟的红细胞(RBC)的相对密度最大,其次是年轻的红细胞(新生细胞)、粒细胞、单核细胞、血小板,最后是血浆。过滤利用颗粒大小的不同来分离血浆和细胞。
目前许可的TPE设备可以连续或间歇流量运行。离心和膜式设备都是可用的。在输血科或血液科等科室,TPE通常用离心系统(cTPE)进行,通常使用枸橼酸盐抗凝。在大多数肾内科和ICU中,首选的设备是基于膜的(mTPE),包括多功能肾脏替代治疗(RRT)机器。在cTPE和mTPE中,血浆去除后剩余的富含细胞的血液与替换液(如白蛋白、血浆或晶体)混合并返回给患者,以防止低血容量。为了减少成本和供体暴露,高达30%的置换液可能是合适的晶体。在低资源保健系统中,由于白蛋白底物的费用以及血浆产品的可用性和安全性,超过置换体积30%的血浆、晶体或非血浆胶体可用于置换。等离子体去除效率(PRE)是用来比较TPE设备的指标。它描述了通过设备并在每次操作中被清除的血浆百分比(%)。PRE 估计可能会根据使用的数学公式而有所不同。使用 cTPE 设备,PRE 比使用 mTPE 设备更快。IgG 的清除率与 cTPE 和 mTPE 相当,但与纤维蛋白原的清除率不同。
血管通路
TPE血管通路的选择主要取决于所采用的方法:cTPE通常需要比mTPE(150-200mL/min)更低的血流速度(Qb)(50-120mL/min)。较低的 Qb 可以使用更窄的导管,例如外围设备(例如,18 号针头)或标准的三腔中心静脉导管(例如,7 Fr)。对于外周静脉,使用 cTPE 时单针通路是可行的,但可能会增加治疗时间。外周插入的中心导管不适合,因为它们狭窄的导管内径会随着 TPE 期间施加的负压而塌陷。mTPE 装置通常需要更高的 Qb,因此需要更宽的导管,例如临时血液透析导管或大直径双腔导管(例如,13.5 French)。TPE导管的最佳特性是管壁坚硬、直径大、长度短,以减少阻力和减少仪器报警。用于cTPE的机器可以将红细胞浓缩到80%或更高的红细胞压积,这使得与mTPE设备相比,每体积处理的血浆更多。mTPE设备需要更高的Qb,因为它们通常只提取约30–35%的处理过的血浆,以防止高血细胞比容对红细胞的损害。因此,对于mTPE装置,必须处理三倍或四倍的血浆量,以去除与cTPE装置相似的血浆量。
抗凝
TPE抗凝的目的是在防止昂贵血液成分损失的管路故障和防止出血之间达到微妙的平衡。全身性肝素和局部枸橼酸盐是最常见的抗凝剂,而当枸橼酸盐不可用且肝素禁忌时也可使用依前列醇。在过去,枸橼酸盐一般用于cTPE,肝素用于mTPE,但现在枸橼酸盐也用于mTPE。根据世界单采登记处的数据,其中三分之二的单采是治疗性的,73%的治疗提供了枸橼酸盐抗凝。
肝素抗凝和枸橼酸盐抗凝各有优缺点(表2)。在TPE过程中,使用枸橼酸盐的出血风险低于使用肝素。然而,当枸橼酸盐与mTPE设备一起使用时,副作用更频繁,主要是因为由于Qb较高,需要更多的枸橼酸盐,加上血浆的清除较少,导致更多的枸橼酸盐进入患者的体循环。症状性低钙血症也更常见于枸橼酸盐,可通过预防性钙给药来预防。市面上可用的mTPE设备,带有根据流出量调整Qb的功能加上钙补充的综合枸橼酸盐给药,降低了风险。肝素用于抗凝时,所需剂量的估算应考虑药物及其辅因子抗凝血酶的体外损失。此外,抗凝血酶的丢失可能会妨碍肝素的抗凝作用。
置换液
白蛋白或血浆可以单独或组合用作置换液,并且可以添加或不添加晶体如盐水。最常用的是白蛋白,因为与血浆相比,它发生过敏或免疫反应(例如,输血相关的急性肺损伤)的频率较低,与输血传播疾病的风险无关。表3总结了每种选择的利弊(表3)。当使用白蛋白作为置换液时,由于白蛋白具有酸性特征,TPE后可能会出现代谢性酸中毒。白蛋白输注也可能影响纤维蛋白原和其他凝血因子的浓度,导致血栓弹力图参数的严重紊乱。
如果要替换血浆成分(如TTP中的ADAMTS13),则需注明血浆成分。尽管缺乏确凿的证据,许多中心也使用血浆来防止凝血因子耗尽(例如,如果存在出血倾向或计划进行侵入性手术)。目前缺乏TPE期间止血监测/管理的既定指南,但需要考虑促凝因子和抗凝因子的体外损失。
ASFA一个小组委员会最近的一项调查发现,置换液的类型在实践中存在很大差异,但通常根据潜在的出血风险来选择置换液类型。由于血浆的体积大、供体暴露的次数多,而且治疗时间往往较长,因此使用血浆的过敏反应风险比使用白蛋白的风险更高,一些中心在使用血浆时会使用抗组胺药物和/或糖皮质激素。当血浆作为替代溶液时,由于作为抗凝剂的枸橼酸盐的代谢和储存的血浆中存在枸橼酸盐,可能会发生代谢性碱中毒。每代谢一个枸橼酸分子,就会消耗一个氢离子,产生三个碳酸氢钠分子,从而提高血清pH值水平。
可以添加晶体以控制成本,并用于高粘滞综合征患者。然而,如果用晶体替代血浆的比例超过30%,那就有低血压的风险。在这种情况下,当水跟随其浓度梯度从血管内空间进入血管外空间时,会发生显著的流体移动。当晶体用作置换的一部分时,应在置换开始时而不是结束时给药,以避免明显的液体转移和低血压。由于羟乙基淀粉(HES)对肾功能和凝血功能都有不良影响,所以它不再被推荐用于危重病患者,然而,它仍然偶尔被用作置换液(例如,3%的HES和5%的人类白蛋白),特别是在资源匮乏的医疗保健系统中。它也可以用于拒绝血液产品的患者。
临床反应
TPE的预期益处和潜在的有害影响取决于与发病相关的治疗时机、液体交换量、置换液的类型以及血浆清除的频率和间隔。“临床反应”的个体标准具有高度的疾病特异性,范围从单个或多个血液学参数、抗体浓度或生化的变化到临床体征和症状的改善。根据基础疾病的不同,TPE的影响可能是快速的,也可能是缓慢的,可能持续数周到数月。然而,长期影响(包括心理健康和急性疾病以外的慢性器官功能障碍)的风险很少有报道。
并发症
TPE是一种相对安全的手术,通常耐受性良好。并发症包括导管相关和操作相关事件。随着时间的推移,不良事件的发生率已经下降,现在根据使用的血管通路、置换液的类型和抗凝治疗,不良事件的发生率在5%到36%之间。有0.4-1.6%的患者报告了导管相关感染、气胸和局部出血。在危重患者中,出血性疾病很少见(小于10%),但导管功能障碍是最常见的并发症(32%)。mTPE和cTPE的并发症发生率相似。据报道,在 1-2% 的危重患者的 TPE 疗程中可能出现危及生命的并发症, 主要是类过敏反应和严重低血压。应通过与单采专家密切合作,明智地选择血管通路,将这些风险降至最低。枸橼酸盐抗凝和血浆置换是低钙血症和感觉异常的危险因素。血浆置换与较高的过敏反应风险相关。另一方面,用白蛋白替代不能纠正凝血因子和免疫球蛋白的消耗和平衡,有导致出血和感染的潜在风险。
TPE清除药物
通过TPE去除药物的数据是稀缺的,仅基于病例报告或病例系列。对于大多数药物,要么没有可用信息,要么不重要。 对于具有低分布容积的高蛋白结合药物和嵌合抗体,可非常有效的清除。与临床有意义的药物清除相关的因素包括药物特性(分布体积、蛋白结合亲和力、内源性清除率、分布半衰期、与剂量相关的药效学)、TPE特性(清除的血浆体积、疗程间隔、第一次和最后一次疗程之间的时间)和给药时间。TPE期间出现的重要的个体间和个体内药代动力学差异以及多组分的动力学模式可能使预测变得非常困难。
最近回顾了TPE过程中抗生素的清除。抗生素是应该在TPE之前还是之后使用,也取决于它的药理学特性。最好在手术前给予氨基糖苷类药物,既能受益于具有杀菌作用的高峰期,又能受益于通过体外清除低谷水平而降低的毒性。另一方面,血浆β -内酰胺水平应维持在最低抑制浓度以上,这通常需要补充剂量。单抗如利妥昔单抗具有较小的分布体积和较长的分布半衰期,因此可被TPE明显去除。在TPE期间,随着血浆浓度的降低,药物的总清除量会随着时间的推移而减少。尽管单抗水平与临床疗效相关,但它们可能与药物动力学标志物(即利妥昔单抗的CD20+B细胞计数)无关。据报道,在TPE过程中,依诺肝素、他罗莫司和霉酚酸可被显著清除。大多数研究涉及TPE后给药和24-36小时后安排下一次TPE治疗。一般而言,治疗药物监测应尽可能应用于接受连续TPE治疗的危重患者,尤其是当药物的治疗指数较窄时。采样时间应考虑血浆浓度反弹。
未解决的问题和研究议程
TPE 的潜在新机制和新出现的 ICU 适应症
对于表1中列出的ICU中最紧急的TPE适应症,TPE的疗效被认为源于去除病原物质和/或提供缺乏的保护分子。这一经典的血液净化概念可能适用于在各种危重情况下遇到的全身性炎症综合征,但时机和抗炎/促炎平衡可能是确定获益与潜在危害的关键。因此,从血小板减少症到弥散性血管内凝血的消耗性凝血病的炎症过程可能对TPE有反应。此外,TPE消除了由受损细胞释放的与损伤相关的分子模式(DAMPs ),这些分子模式可能引发和延续多器官功能障碍。在有脓毒症和多器官功能障碍的患者中,TPE可逆转休克,改善血管通透性和凝血功能异常,同时也有提高存活率的趋势。
鉴于TPE具有调节全身炎症和凝血功能的能力,它对重症COVID-19患者的潜在益处引起了人们的兴趣。此外,TPE 可以纠正 COVID-19 患者中血管性血友病因子多聚体增加和 ADAMTS13 活性降低。在一项小型随机对照试验中,恢复较快,但对死亡率没有影响。包括随机对照试验在内的许多研究正在进行中,以使用略有不同的方案来检验各种假设。除脓毒症外,临床表现为全身性炎症反应的情况可通过TPE改善,包括噬血细胞淋巴组织细胞增多症、巨噬细胞激活综合征、嵌合抗原受体T细胞相关细胞因子释放综合征、严重胰腺炎和严重烧伤。到目前为止,现有的证据仍然局限于病例系列和未干预的观察性研究。最后,TPE最近已被用于疫苗诱导的难治性血栓和血小板减少症,尽管证据仍然有限,但这可能被添加到抢救治疗的范围内。
TPE的启动
需要确定合适的TPE启动时间。支持TPE启动的生物标志物水平、抗体滴度或临床症状因适应症而异。需要确定与不良结果相关的具体阈值。值得注意的是,在 ICU 中遇到的炎症综合征也可以作为监测 TPE 有效性的标志物,例如内皮激活和原发性止血的标志物。尽管创伤和脓毒症是两种不同的疾病,但在这两种情况下,糖萼脱落生物标志物的升高(如Syndecan-1和乙酰肝素硫酸盐)与不良预后相关,而TPE可以降低它们的水平。此外,在败血症和创伤中都发现了 ADAMTS13 和von Willebrand 因子之间的不平衡。已经提出了具体的阈值,但这些是否对指导 TPE 有用仍未可知。
TPE与其他干预措施的比较
在大多数情况下,与其他技术相比,TPE的疗效尚不清楚。在GBS和重症肌无力中,TPE的有效性与IVIG或两者的组合进行了比较。对于与致病抗体相关的情况,有限的证据表明,TPE和更具选择性的免疫吸附技术可能具有类似的疗效,但还需要更多的研究。此外,在某些情况下,新数据可能会挑战TPE的优势。PEXIVAS研究等试验导致AFSA将严重的ANCA相关血管炎从TPE的I类适应症改为II类适应症。
TPE的技术方面
很少有证据支持ICU患者的标准TPE方案。更具体地说,目前所有的治疗方案都是基于对病房病人或门诊病人的长期治疗经验而制定的。ICU患者可能由于器官衰竭、毛细血管渗漏和/或低白蛋白血症而改变了分布容积。理想情况下,TPE方案应该根据患者的需要量身定制。需要更多关于危重患者最佳TPE间隔和容量的信息,以及最佳置换方案和与低反弹风险相关的停止截止值。
结论
TPE是现代重症监护中的一种公认的治疗方法。它包括离心和基于膜的技术,并且需要用血浆或白蛋白溶液进行液体置换。我们总结了要点(表3)。尽管TPE在许多疾病中被认为是一线或二线治疗,但仍然存在显著的知识差距,特别是关于启动和停止的确切时机、监测的最佳标记物。此外,在TPE过程中,常规实验室血液检查和药物剂量的解释具有挑战性。需要更多的观察性和介入性研究来填补现有的知识空白,以确定可能从 TPE 中受益的患者,并注意鉴别不适应TPE的患者,并避免对那些不会受益或可能受到伤害的人进行TPE。
![]()